- [主题分类]
- [发文单位]
- [发布日期]
- [联合发文单位]
- [实施日期]
- [发文字号] 〔〕号
- [废止日期]
- [成文日期]
- [有效性]
Nature Photonics突破 | 陈良怡团队合作发明SACD方法实现高通量超分辨成像
2023年6月15日,北京大学陈良怡团队与哈尔滨工业大学李浩宇/赵唯淞团队合作在Nature Photonics上在线发表论文Enhanced detection of fluorescence fluctuations for high-throughput super-resolution imaging1。他们提出可以利用预解卷积技术对图像进行处理,以提升荧光涨落现象的开关对比度,从而将重建所需的原始图像数量缩减至少两个数量级。同时在计算自相关累积量后再次进行解卷积,以进一步提升结果的分辨率。基于上述原理,他们发明了自相关两步解卷积超分辨成像(Super-resolution imaging based on Auto-Correlation with two-step Deconvolution,SACD)方法,在无需额外硬件的条件下,实现了目前活细胞中通量最高的超分辨成像。从原来的需要1000帧的成像降低到只需要20帧,就能实现超过2倍的三维空间分辨率提升。结合商业的转盘共焦(Spinning Disk Confocal,SDC)显微镜,可以实现快速毫米级视场成像或者四维活体成像。

超分辨率成像突破衍射极限的限制,在纳米尺度能够对细胞内部精细结构和生物分子实现高精度可视化和动态追踪,已经发展为生命科学领域一个重要的研究工具。如何实现超高分辨率、长时程、高通量的活细胞超分辨成像一直是陈良怡课题组的重点研究方向。课题组在2018年发明了超灵敏海森结构光超高分辨率显微镜(Hessian SIM),空间分辨率可以达到85纳米2。为了进一步拓展荧光显微镜的分辨率极限,课题组在2022年发明了基于稀疏解卷积的结构照明显微镜(Sparse-SIM),实现空间分辨率(60nm)下,速度最快(564Hz)、成像时间最长(1小时以上)的超分辨成像3。超分辨显微镜虽然能够实现极高的分辨率,但低通量是其中一个限制性因素。相较于超分辨显微镜,共聚焦荧光显微镜在实验室中更容易获得,由于在z轴上具有光学切片能力,且更容易实现高通量,受到生物学家的青睐,然而其能达到的空间分辨率却十分有限。基于荧光涨落物理特性的超分辨成像技术(Super-resolution optical fluctuation imaging,SOFI)4 可以与共聚焦系统相结合,在不需要额外光学元件的情况下突破衍射极限,但通常需要1000帧以上的原始图像才能得到一张超分辨图像,其时间分辨率不能满足生物医学对瞬态细胞器动力学成像的需求。
与传统结构光显微镜的成像深度受限不同,SACD技术应用于转盘共焦显微镜上可以实现深层细胞中的三维分辨率扩展。首先,研究者测量了其三维分辨率(图1a),将单个荧光探针颗粒随机分散在基底上,并通过转盘共焦显微镜观测。研究者测量出该点源的横向/轴向的半峰全宽为325/655纳米,在使用SOFI的重建结果中为296/510纳米,而在使用SACD重建结果中为135/33纳米(均使用20帧重建)。这表明,SACD可以在三维上有效地实现超过两倍的分辨率提升。
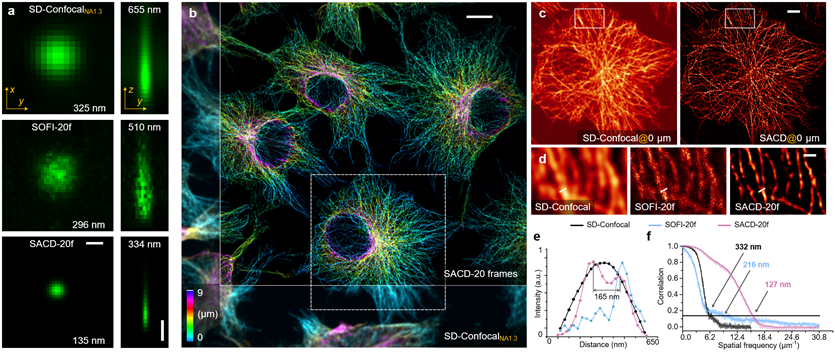
图1| SACD三维深层超分辨成像
(a)最大强度投影(左)、垂直截面(右),单个荧光探针颗粒成像,转盘共焦显微镜(上)、20帧的SOFI(中)和20帧的SACD(下)。
(b)COS-7细胞中细胞骨架微管蛋白的三维伪彩图,转盘共焦显微镜(左下)和SACD(右上)。
(c)(b)中白色虚线框的放大的水平剖面图。
(d)(c)中白色虚线框的放大区域。
(e)(d)中白线位置的微管细丝强度分布,转盘共焦显微镜(黑色)、20帧的SOFI(蓝色)和20帧的SACD(红色),数字表示峰值之间的距离。
(f)重建图像的FRC分辨率分析。比例尺:(a中的横向和轴向)500纳米;(b)10微米;(c)5微米;(d)1微米。
接下来,研究者通过对细胞骨架微管的成像来展示SACD真正的三维超分辨能力。由于SACD不需要特定的光学照明和配置,可以直接使用sCMOS相机来实现三维超分辨成像,进而具备更大的视场范围。利用这一优势,研究者在深度达9微米的范围内同时对多个COS-7细胞进行了成像,并实现了两倍分辨率提升(图1b)。在这种配置下,20帧的SOFI图像质量受限,连续性不佳(图1d)。相比之下,20帧的SACD(图1d)能够提供高质量重建图像,如图1e所示,距离为165纳米的微管细丝可以被清晰地区分出来。FRC分辨率分析(图1f)也表明SACD(127纳米,红色)的分辨率显著优于20帧的SOFI (216纳米,蓝色),而且这种优势在所有空间频率上都表现明显。
由于不需要额外的光学器件,与光闪烁探针结合,SACD可以直接为各种荧光成像系统提供超分辨功能。研究者们将SACD算法与商用转盘共焦显微系统结合,实现了对毫米级视场内(2毫米×1.4毫米)微管的高通量超分辨成像(图2a),包含多达2000个细胞。传统SOFI需要几乎半天的连续采样才能对整块区域完成重建,而SACD只需10分钟便可达到相似甚至更加优越的成像性能。研究者们对Nop56和B23这两种核仁蛋白进行了活细胞成像(图2b-e),SACD在保持线性强度的同时还能可靠地提高分辨率,同时具有比SIM更高的对比度。总而言之,SACD对不同类型生物样品具有广泛适用性。

图2| SACD高通量超分辨成像
(a)SACD(20帧)在包含2000多个细胞的2.0毫米×1.4毫米区域内实现高通量超分辨率成像, COS-7细胞中的细胞骨架微管蛋白成像结果。
(b)用Nop56-Skylan-S标记的活COS-7细胞在宽场显微镜(左)、2D-SIM(中)和SACD(右)下的成像结果。
(c)宽场显微镜(第1列)、SOFI(第2列,20帧)、2D-SIM(第3列)、SACD(第4列,20帧)的结果比较(b中白框所示的放大区域)。
(d)用B23-rsFusionRed3标记的活COS-7细胞在宽场显微镜(左)、2D-SIM(中)和SACD(右)下的成像结果。(e)宽场显微镜(第1列)、SOFI(第2列,20帧)、2D-SIM(第3列)、SACD(第4列,20帧)的结果比较(d中白框所围的放大区域)。比例尺:(a)100微米;(b, d)5微米;(c, e)1 微米。

movie1| 高通量成像——大视场细胞骨架微管成像
真正高稳定性和高保真度的活细胞超分辨成像总是具有挑战性的,其受到信噪比、光漂白和光毒性的严重限制。在这种情况下,研究者们引入了之前开发的稀疏解卷积3方法,其主要通过时空上的连续性和稀疏性对原始图像进行背景预滤除和后解卷积,以最大限度地利用原始图像中的信息(Sparse-SACD)。研究者使用SACD技术进行了全活细胞四维超分辨成像,即在超过10分钟时间(成像温度37°C)内对COS-7活细胞的线粒体外膜网络进行三维超分辨体成像(图3)。与传统共焦系统相比,精细结构的可见性得到了彻底地提高,线粒体被清晰地成像为锐利的中空膜结构。通过稀疏性和连续性的双重约束,SACD高保真地实现了随时间变化的全细胞线粒体裂变与融合成像。
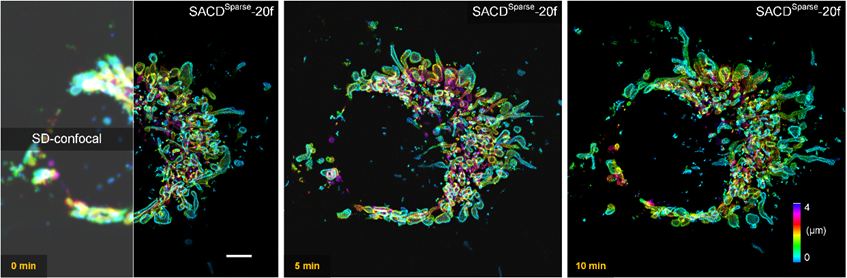
图3| SACD活体四维超分辨成像。转盘共焦显微镜(SD-confocal,左)和Sparse-SACD(右)在37°C下对Skylan-S-TOM20标记的活COS-7细胞进行四维成像。比例尺:5微米。

Movie2| 活体细胞骨架(MAP4)的转盘共焦、SOFI、SACD、Sparse-SACD的连续成像结果对比
通过充分利用原始图像中的荧光波动,SACD可以在商业系统上直接实现三维分辨率的提高。因此,研究者们期待SACD成为生物学家分析活细胞中复杂瞬态动力学的常规工具,以助于高通量、高分辨率和低成本地进行基于显微镜的筛查。
哈尔滨工业大学助理教授赵唯淞、北京大学特聘副研究员赵士群、哈尔滨工业大学博士生韩镇谦和丁相妍为论文共同第一作者。哈尔滨工业大学李浩宇教授和北京大学国家生物医学成像科学中心陈良怡教授为论文的通信作者。其中,另外共同通信作者还有哈尔滨工业大学丁旭旻教授和京津冀国家技术创新中心/北京大学郭长亮副研究员。该项目的数据处理获得了北京大学未名超算平台的硬件和技术支持。该课题得到国家自然科学基金,国家重点研发项目,北京市自然科学基金以及生命科学联合中心等支持。
参考文献
1. Zhao W, Zhao S, Han Z, et al. Enhanced detection of fluorescence fluctuations for high-throughput super-resolution imaging. Nature Photonics, 2023: DOI: https://doi.org/10.1038/s41566-023-01234-9.
2. Huang X, Fan J, Li L, et al. Fast, long-term, super-resolution imaging with Hessian structured illumination microscopy. Nature Biotechnology, 2018, 36(5): 451-459.
3. Zhao W, Zhao S, Li L, et al. Sparse deconvolution improves the resolution of live-cell super-resolution fluorescence microscopy. Nature Biotechnology, 2022, 40(4): 606-617.
4. Dertinger T, Colyer R, Iyer G, et al. Fast, background-free, 3D super-resolution optical fluctuation imaging (SOFI). PNAS, 2009, 106(52): 22287-22292.





